Abteilung für Innere Medizin
(Chefärztin Priv.-Doz. Dr. V. Hach-Wunderle)
Venöser Gefäßstatus
Viola Hach-Wunderle
Die Venenkrankheiten bieten ein vielfältiges Spektrum von klinischen Krankheitsbildern, das von der Krampfader über die akute Bein und Beckenvenenthrombose bis zum chronischen Faszienkompressionssyndrom reicht. Der Therapeut sollte heute so früh wie möglich eine aktive Stellung beziehen, um die Entstehung von chronischen Krankheitsprozessen zu verhindern. Als Voraussetzung für jede Behandlung gilt eine differenzierte Diagnostik. Bei allen Krankheiten am Venensystem nehmen die bildgebenden Verfahren einen vorrangigen Stellenwert ein; Phlebographie und Sonographie ergänzen sich dabei optimal in ihren artspezifischen Aussagen. Die globalen Funktionstests vermitteln wichtige additive Informationen hinsichtlich der Quantifizierung von Befunden, aber auch in der Verlaufsbeurteilung und der Prognose.
 Schematische Darstellung des venösen Systems der Bein- und Beckenvenen. Im Gegensatz zu den Arterien, die einem Baum mit seinen Verzweigungen gleichen, entsprechen die Venen dem Aufbau eines Netzes, in dem einzelne Streben stärker hervortreten. Nur dadurch sind die Pathophysiologie der einzelnen Krankheitsbilder, die Aussagekraft von Untersuchungsergebnissen und die Prinzipien der Therapie zu verstehen.
Schematische Darstellung des venösen Systems der Bein- und Beckenvenen. Im Gegensatz zu den Arterien, die einem Baum mit seinen Verzweigungen gleichen, entsprechen die Venen dem Aufbau eines Netzes, in dem einzelne Streben stärker hervortreten. Nur dadurch sind die Pathophysiologie der einzelnen Krankheitsbilder, die Aussagekraft von Untersuchungsergebnissen und die Prinzipien der Therapie zu verstehen. Für die Praxis ist die Feststellung der primären Lokalisation einer Venenkrankheit wichtig. Die Phlebothrombose beginnt definitionsgemäß in den tiefen Leit- oder Muskelvenen der Bein- und Beckenregion. Sie kann im weiteren Krankheitsverlauf dann aber auf die oberflächlichen Gefäße übergreifen. Ganz andere Bedingungen liegen vor, wenn der Thrombus primär in einer Stammvarikose der V. saphena magna entsteht und sekundär in das tiefe Venensystem einwächst. Während im ersten Falle die Thrombolyse als Therapie der Wahl erhalten bleibt, wird bei einer Varikophlebitis der Stammvenen ohne Verzögerung die operative Sanierung mit den besten Erfolgsaussichten anzustreben sein.
Die letzte prinzipielle Frage betrifft den Einsatz der zweckmäßigen Untersuchungsmethoden für die vorgegebene Fragestellung. In den letzten Jahren hat sich ein grundlegender Wandel im diagnostischen Stufenprogramm vollzogen. Die bildgebenden Verfahren nehmen eine dominierende Rolle ein, wahrend die globalen Meßmethoden mehr und mehr die Langzeitkontrollen begleiten (Tab. 1):
| Tabelle 1. Apparative Untersuchungsmethoden bei Venenkrankheiten |
| Aktuelle bildgehende Verfahren |
| Konventionelle Phlebographie |
| Digitale Subtraktionsphlebographie |
| Computertomographie |
| Kernspintomographie |
| B-Bild-Sonographie |
| Duplexsonographie |
| Selektive Meßmethoden |
| Nicht-direktionale Sonographie |
| Direktionale Sonographie |
| Globale Meßmethoden |
| Periphere Phlebodynamometrie |
| Venenverschlußplethysmographie |
| Photoplethysmographie (LRR) |
Primäre Varikose
Bisher galt die primäre Varikose definitionsgemäß als eine Erkrankung des extrafaszialen Venensystems. Heute wissen wir, daß diese Feststellung nur auf Krampfadern vom retikulären Typ und auf bestimmte Seitenastvarizen zutrifft. Die Stammvarikose jedoch beeinträchtigt mit zunehmender Schwere und Krankheitsdauer alle Venensysteme der unteren Extremität. In ihrem Endstadium verursacht sie mit der Dermatolipofasziosklerose und dem arthrogenen Stauungssyndrom ein chronisches Leiden, das erst in jüngster Zeit durch die modernen Operationsmethoden an der Fascia cruris heilbar geworden ist.
Epidemiologie
In den Industrieländern der westlichen Prägung ist die primäre Varikose außerordentlich verbreitet. Nach neueren Studien beträgt die Prävalenz einer leichtgradigen Krampfaderkrankheit bei Erwachsenen 25 - 50%, einer fortgeschrittenen Varikose 5 - 15% und des Ulcus cruris 1 - 4 %. Nur 20 - 50% der Bevölkerung sind demnach venengesund.
Die einzelnen Formen der Varikose zeigen ein unterschiedliches epidemiologisches Verhalten. Die Stammvarikose der V. saphena magna und parva beginnt weitaus am häufigsten im 3. Lebensjahrzehnt. Sie ist also eine Krankheit der jungen Menschen, wird allerdings erst viel später erkannt. Es liegt eine kongenitale Dysfunktion der Mündungsklappe vor, die erst durch die Einwirkung von verschiedenen Manifestationsfaktoren wie stehender Beruf, Schwangerschaft oder hormonelle Antikonzeption zur Klappeninsuffizienz führt. Die Varikose der Cockett-Perforansvenen entwickelt sich im Rahmen eines Rezirkulationskreises der Stammvarikose meistens erst viele Jahre später. Retikuläre Varizen haben keine bestimmte altersmäßige Zuordnung; sie entstehen in jedem Lebensalter, beim älteren Menschen aber häufiger.
Pathogenese und Einteilung
Aufgrund morphologischer Kriterien müssen verschiedene Formen der primären Varikose differenziert werden, die sich auch in epidemiologischer und nosologischer Hinsicht unterscheiden. Dabei spielt eine entscheidende Rolle, ob eine unmittelbare Beziehung zum tiefen Venensystem vorhanden ist oder nicht (Tab. 2).
| Tabelle 2. Einteilung der primären Varikose nach morphologischen Merkmalen |
| Stammvarikose |
| V. saphena magna |
| V. saphena parva |
| Inkomplette Formen |
| Seitenastvarikose |
| V. saphena accessoria lateralis |
| V. saphena accessoria medialis* |
| V. arcuata cruris anterior* |
| V. arcuata cruris posterior* |
| V. femoropoplitea |
| Perforansvarikose |
| Cockett´sche - Venen |
| Boyd´sche- Vene |
| Dodd´sche- Vene |
| Hach´sche - Vene |
| Retikuläre Varikose |
| Subkutane Venen * |
| * Ohne direkte Beziehung zum tiefen Venensystem |
Die wichtigste Krankheit der primären Varikose ist die Stammvarikose der V. saphena magna. Die variköse Degeneration beginnt bei der kompletten Form am proximalen Insuffizienzpunkt in der Leiste. Von dort schreitet sie nach distal bis zum Abgang eines anatomisch präformierten Seitenastes fort, dem distalen Insuffizienzpunkt. Unterhalb davon verzweigen sich die großen Krampfaderkonvolute, der Saphenastamm bleibt jedoch suffizient.
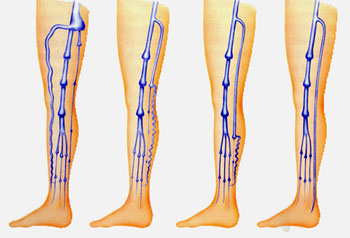
Einteilung einer Stammvarikose der V. saphena magna in 4 Krankheitsstadien aufgrund der Lokalisation des distalen Insuffizienzpunktes.
Wenn sich der proximale Insuffizienzpunkt nicht in der Leiste, sondern an einer anderen Seite des Beins befindet, sprechen wir von einer inkompletten Form der Stammvarikose (s. unten, Abbildung 5). Davon gibt es den Seitenast-, den Perforans- und den dorsalen Typ.
Nach der Lage des distalen Insuffizienzpunktes werden bei der V. saphena magna 4 und bei der V. saphena parva 3 Krankheitsstadien differenziert. Sie bilden die Grundlage für die Konzeption der Rezirkulationskreise.
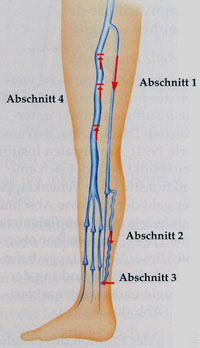
Schematische Darstellung des dekompensierten Rezirkulationskreises III bei einer Stammvarikose der V. saphena magna. Abschnitt 1: Stammvarikose zwischen dem proximale Insuffizienzpunkt in der Leiste und dem distalen Insuffizienzpunkt am Unterschenkel. Abschnitt 2: Obligatorische Seitenastvarikose, die am distalen Insuffizienzpunkt entspringt und nach distal zieht. Abschnitt 3: V. perforans, über die das rezirkulierte Blutvolumen wieder dem tiefen Venensystem zugeführt wird, um ein zweites Mal nach proximal abzufließen. Abschnitt 4: Überlastung der tiefen Leitvenen durch das erhöhte, rezirkulierende Blutvolumen und Entwicklung einer sekundären Leitvenen-Insuffizienz.
Mit der Zeit werden die Venen der poplitealen und femoralen Region durch das ungewöhnlich hohe Blutvolumen überlastet. Sie erweitern sich, bis die Klappen nicht mehr abschließen. Die Effektivität der peripheren Venenpumpe fällt aus, es resultieren eine antegrade Strömungsinsuffizienz und mit ihr das chronisch-venöse Stauungssyndrom. Der Rezirkulationskreis ist dekompensiert.
Nach der Lage des distalen Insuffizienzpunktes lassen sich die Rezirkulationskreise gemäß den Stadien der Stammvarikose in die Typen I IV einteilen. Je nachdem, ob die tiefen Venen suffizient sind oder ob eine sekundäre Leitveneninsuffizienz vorliegt, erfolgt die weitere Differenzierung von kompensierten und dekompensierten Rezirkulationskreisen. Zwischen der Lage des distalen Insuffizienzpunktes und der Entstehungszeit des chronisch-venösen Stauungssyndroms gibt es eine feste Korrelation: Je weiter distal er liegt, um so früher dekompensiert der Rezirkulationskreis (Tabelle l).
| Tabelle 3. Zusammenhang zwischen distalen Insuffizienzpunkt und Entstehung des Stauungssyndroms |
| Stadium | Lage des distalen Insuffizientzpunktes | Entstehungszeit des chronisch-venösen Stauungssyndroms |
| I | Leiste | > 25 Jahre (sehr selten) |
| II | Distaler Oberschenkel | > 25 Jahre |
| III | Proximaler Unterschenkel | 12,5-25 Jahre |
| IV | Fuß | Sofort, bzw. in der Jugendzeit |
Erst die sekundäre Popliteal- und Femoralvenen-Insuffizienz bildet die Voraussetzung für die dermatologischen Komplikationen des chronisch-venösen Stauungssyndroms. Zunächst treten nur leichte periphere Ödeme unter hydrostatischer Belastung auf. Dann werden die Gewebe der supramalleolären Region von einer zunehmenden Fibrosierung betroffen. Wahrscheinlich löst die Einbeziehung der Fascia cruris ein orthostatisches Kompartmentsyndrom aus, das in der Pathogenese des chronisch-persistierenden Uicus cruris eine Schlüsselrolle spielt.
Als schwere Komplikation des dekompensierten Rezirkulationskreises gilt das arthrogene Stauungssyndrom. Es entsteht, wenn der chronische Entzündungsprozeß auch auf den Bandapparat des Sprunggelenks übergreift und zum fixierten Spitzfuß und damit zum Ausfall der peripheren Venenpumpen führt. Die Ulzerationen haben keine Chance der dauerhaften Abheilung mehr.
Eine neue Krankheitsentität stellt das Faszienkompressionssyndrom dar (s. unten). Es wird wie folgt definiert: schwerste Mikrozirkulationsstörung im Bereich des Unterschenkels infolge eines orthostatischen Kompartmentsyndroms durch narbige Destruktion der Fascia cruris, einhergehend mit bisher unheilbaren Manschetten-Ulzera, Nekrosen und Glykogenverarmung der Muskulatur, funktioneller arterieller Minderdurchblutung, Versteifung in den Sprunggelenken sowie fakultativ assoziiert mit Eisenmangelsyndrom, entzündlichen humoralen Reaktionen, Depressionen und sozialem Abstieg.
Diagnostische Maßnahmen
Die verschiedenen Krankheitsbilder der primären Varikose lassen sich manchmal schon durch die eingehende klinische Untersuchung differenzieren. Darüber hinaus kommt es aber auf die Erkennung aller Einzelheiten eines Rezirkulationskreises an. Das Untersuchungsprogramm umfaßt zunächst die selektiven und die bildgebenden Verfahren zur Beurteilung der 4 Abschnitte des Rezirkulationskreises. Die globalen Meßmethoden liefern quantitative Informationen über verschiedene Parameter der venösen Hämodynamik.
Den 1. Abschnitt des Rezirkulationskreises bildet die (komplette) Stammvarikose der V. saphena magna. Sie läßt sich an einem schlanken Patienten schon bei der klinischen Untersuchung erfassen. Mit der nicht-direktionalen und der direktionalen Dopplersonographie wird unter dem Valsalva-Test über der V. saphena magna eine starke Regurgitation festgestellt, und am stehenden Patienten ergibt sich beim Wadendekompressionstest ein unerschöpfbares Rückstromsignal. Sobald ein typisches klinisches Bild und die direktionale Dopplersonographie vollkommen übereinstimmen, sind die minimalen Anforderungen an die Diagnostik erfüllt.
Eine genaue bildliche Analyse aller Einzelheiten des Rezirkulationskreises vermittelt die aszendierende Preßphlebographie als Referenzverfahren. Die wichtigsten röntgenologischen Zeichen der Klappen-Insuffizienz an der Stammvene sind die infravalvulären Dilatationen und Aneurysmen (Abbildung 3). Sie gelten als das verläßliche pathomorphologische Substrat für die Indikation zur operativen Behandlung. Die komplette Form einer Stammvarikose läßt sich auch durch die farbkodierte Duplexsonographie mit hinreichender Sicherheit diagnostizieren; bei der Untersuchung im Liegen und im Stehen ist die erweiterte Stammvene mit den retrograden Strömungsturbulenzen beim Preßversuch und beim Wadendekompressionstest gut zu erkennen (Abbildung 4).
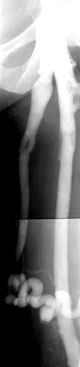 Stammvarikose der V. saphena magna im Stadium II. Darstellung durch die aszendierende Pressphlebographie mit Valsalva-Test. Deutliche infravalvuläre Dilatationen unterhalb des proximalen Insuffizienzpunktes in der Leiste. Abgang der obligatorischen Seitenastvarikose am distalen Insuffizienzpunkt.
Stammvarikose der V. saphena magna im Stadium II. Darstellung durch die aszendierende Pressphlebographie mit Valsalva-Test. Deutliche infravalvuläre Dilatationen unterhalb des proximalen Insuffizienzpunktes in der Leiste. Abgang der obligatorischen Seitenastvarikose am distalen Insuffizienzpunkt. Stammvarikose der V. saphena magna. Darstellung mit der farbkodierten Duplexsonographie in der Leiste. Längsschnitt der Saphena-Mündung im oberen Bildanteil. Farbumschlag der retrograden Strömung unter dem Valsalva-Test von blau in rot.
Stammvarikose der V. saphena magna. Darstellung mit der farbkodierten Duplexsonographie in der Leiste. Längsschnitt der Saphena-Mündung im oberen Bildanteil. Farbumschlag der retrograden Strömung unter dem Valsalva-Test von blau in rot.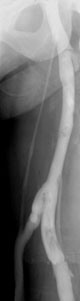 Inkomplette Stammvarikose der V. saphena magna vom Perforanstyp. Proximaler Insuffizienzpunkt in Höhe einer insuffizienten Dodd´schen V. perforans am Oberschenkel. Distal davon Entwicklung der Stammvarikose. Proximaler Anteil der V. saphena magna suffizient. Darstellung durch die aszendierende Pressphlebographie.
Inkomplette Stammvarikose der V. saphena magna vom Perforanstyp. Proximaler Insuffizienzpunkt in Höhe einer insuffizienten Dodd´schen V. perforans am Oberschenkel. Distal davon Entwicklung der Stammvarikose. Proximaler Anteil der V. saphena magna suffizient. Darstellung durch die aszendierende Pressphlebographie.
Zum 2. Abschnitt des Rezirkulationskreises gehört die konjugierende Seitenastvarikose. Sie beginnt am distalen Insuffizienzpunkt. Oftmals sind diese Krampfadern der ursprüngliche Anlaß des Patienten zur ärztlichen Konsultation. Für die Diagnostik reicht die klinische Untersuchung aus.
Der 3. Abschnitt des Rezirkulationskreises bezieht sich auf die Cockett´sche Perforansvarikose. Im aktivierten Zustand bestehen typische lokale Symptome, die in der Regel eine genaue Lokalisation erlauben. Am liegenden Patienten laßt sich durch die gleitende digitale Palpation eine schmerzempfindliche Gewebslücke ertasten, die durch den Canyoneffekt der Krampfader verursacht wird. Im Stehen tritt hier der Blow-out hervor. Mitunter ist die Stelle auch durch Besenreiservarizen oder Pigmentierungen gekennzeichnet.
Die Identifikation der Cockett´schen Perforansinsuffizienz durch die Duplexsonographie oder durch die Phlebographie erscheint zeitraubend und unsicher, da es weder eine feste topographische Zuordnung noch standardisierte Bedingungen für die aktuelle Strömungsdynamik gibt. Sobald der Nachweis durch den retrograden Flow gelingt, gilt die Diagnose als sicher (Spezifität 100%); aber nicht in jedem Fall läßt sich die Perforansinsuffizienz erkennen (Sensibilität <70%).
Der 4. Abschnitt des Rezirkulationskreises betrifft die sekundäre Popliteal- und Femoralveneninsuffizienz. Im Laufe der Zeit werden die tiefen Leitvenen durch das rezirkulierende Blutvolumen überlastet; sie elongieren und dilatieren bis zur Schlußunfähigkeit der Venenklappen; es entsteht eine antegrade Strömungsinsuffizienz. Der periphere dynamische Venendruck steigt an, und es bildet sich das chronisch-venöse Stauungssyndrom aus.
Welche Faktoren für die Entstehung der sekundären Leitveneninsuffizienz richtungweisend sind, ist bisher nur teilweise bekannt. Die größte Bedeutung hat die topographische Position des distalen Insuffizienzpunktes. Bei einem Rezirkulationskreis I wird das klinische Bild von der konjugierenden Seitenastvarikose der V. saphena accessoria lateralis beherrscht. Die starke Schlängelung der Varizen bremst die retrograde Blutströmung so stark ab, daß die hämodynamische Belastung der Peripherie gering bleibt. Veränderungen des dynamischen Venendrucks und eine sekundäre Popliteal und Femoralveneninsuffizienz werden so gut wie nie gesehen (Abbildung 6 a und b).
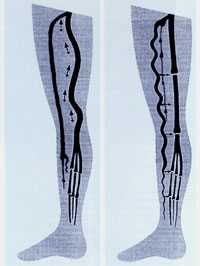 Schematische Darstellung des Einflusses der Topographie des distalen Insuffizienzpunktes auf die Entwicklung der sekundären Leitvenen-Insuffizienz bei der Stammvarikose.
Schematische Darstellung des Einflusses der Topographie des distalen Insuffizienzpunktes auf die Entwicklung der sekundären Leitvenen-Insuffizienz bei der Stammvarikose.a.: Stammvarikose der V. saphena magna im Stadium III. Schnelle Rezirkulation eines großen Blutvolumens zum Unterschenkel und Überlastung der tiefen Leitvenen bis hin zur Leitvenen-Insuffizienz. Je weiter distal der Insuffizienzpunkt liegt, um so stärker wird die hämodynamische Belastung des peripheren tiefen Venensystems.
b.: Stadium I der Stammvarikose (= Seitenastvarikose der V. saphena accessoria lateralis). In der stark geschlängelten Seitenastvarikose wird das rezirkulierende Blutvolumen abgebremst und über Vv. perforantes in mehreren Etagen behutsam den tiefen Venen zugeleitet. Eine Leitvenen-Insuffizienz bildet sich auch bei extremen Krampfadern nicht aus.
Therapeutische Aspekte
Bei der Stammvarikose besteht die Indikation zur operativen Behandlung. Die extrafaszialen Segmente des Rezirkulationskreises werden im Sinne der partiellen Saphenaresektion entfernt. Im Falle der sekundären Popliteal- und Femoralvenen-Insuffizienz führt die Sanierung der extrafaszialen Venen bei jungen Menschen zur Restitutio ad integrum, sonst aber regelmäßig zu einer entscheidenden Besserung.
Bei der akuten Varikophlebitis der V. saphena magna oder parva ist eine sofortige Operation eher angezeigt als die konservative Behandlung. Die Gefahren der Lungenembolie und der transfaszialen Progredienz der Thrombose fallen weg. Außerdem ist der Patient nach dem Eingriff sogleich beschwerdefrei, während er sonst über Wochen in einer aufwendigen ärztlichen Betreuung bleiben muß.
Die retikulären Varizen und bestimmte Formen der Seitenastvarikose eignen sich hervorragend für die Sklerosierung. Auch bei der Stammvarikose des älteren Menschen werden damit noch befriedigende Erfolge erzielt.
Phlebothrombose
Die Phlebothrombose läuft definitionsgemäß in den intrafaszialen Leitvenen des Beins und der Beckenregion sowie in den Muskelvenen ab. Als gefürchtete Komplikationen gelten die Lungenembolie und das postthrombotische Syndrom mit chronisch-venöser Kongestion. Die Thrombose in den oberflächlichen Venen gehört zu dem Begriff der Thrombophlebitis.
Epidemiologie
Neuere Untersuchungen aus den USA haben ergeben, daß pro Jahr 48 von 100 000 Einwohnern an einer Thrombose und 23 von 100 000 Einwohnern an einer Lungenembolie erkranken. Etwa 300 000 Patienten pro Jahr werden mit einer symptomatischen Venenthrombose zur stationären Behandlung in Krankenhäuser eingewiesen. In einem Drittel der Fälle handelt es sich um ein Rezidiv. Die Dunkelziffer der nicht erkannten Thrombosen ist wahrscheinlich sehr hoch.
Prinzipien der Pathogenese und der Einteilung
Der Begriff Thrombose geht auf Rudolf Virchow (1821 – 1902, Pathologe in Berlin) zurück. Als wesentliche Komponenten der Thrombogenese stellte Virchow den Gefäßwandschaden, die Verlangsamung der Blutströmung und Veränderungen in der Zusammensetzung des Blutes heraus (VirchowTrias).
Die Anamnese kann wichtige Hinweise auf die Pathogenese enthalten und damit den Anstoß für eine differenzierte Diagnostik geben.
Für die Endothelschädigung kommen verschiedene Ursachen in Betracht. Am häufigsten wird das direkte mechanische Trauma auf die Venenwand bei Operationen oder Verletzungen angegeben. Hier ist auch die Armvenenthrombose beim zentral-venösen Verweilkatheter einzuordnen. Unter den chirurgischen Eingriffen gehen der Knie- und der Hüftgelenkersatz mit einer hohen Thrombosegefahr einher. Für die "economy-class thrombosi" oder "traveller's thrombosis" werden die Abknickung der V. poplitea in stundenlanger beengter Sitzhaltung bei Langstreckenflügen oder Busreisen und zusätzliche Blutverteilungsstörungen in der peripheren venösen Strombahn verantwortlich gemacht. Auf eine Endothelschädigung ist wahrscheinlich auch die "Thrombose des ersten Ferientages" zurückzuführen, die bei untrainierten Bergsteigern nach körperlicher Überlastung in der V. poplitea auftritt. Bei schweren Allgemeinkrankheiten sind zytotoxische Einflüsse anzunehmen.
Die Entstehung und das Wachstum von venösen Thromben werden durch eine Verlangsamung der Blutströmung induziert. In der Klinik ist die veränderte Kreislaufdynamik bei der Immobilisierung des Patienten gegeben. Dazu gehören die Anordnung von strenger Bettruhe ebenso wie die Ruhigstellung der unteren Extremität im Gipsverband. Eine globale Beeinträchtigung der Blutströmung liegt auch bei der Herzinsuffizienz vor. Lokale Durchblutungsstörungen finden sich bei der tiefen Leitveneninsuffizienz im Rahmen des dekompensierten Rezirkulationskreises der Stammvarikose und beim postthrombotischen Syndrom.
Von großer Bedeutung für die Thrombogenese im Venensystem sind Veränderungen in der Zusammensetzung des Blutes. Die gesteigerte Gerinnbarkeit des Blutes (Hyperkoagulabilität) kann durch eine erhöhte Aktivität von Thrombozyten und Gerinnungsfaktoren oder durch eine verminderte Fibrinolyse verursacht sein. Für diese Situation wurde der Begriff Thrombophilie eingeführt. Die Defekte sind entweder angeboren oder im Rahmen von bestimmten Krankheiten erworben. Der Verdacht auf einen hereditären Defekt ergibt sich bei Patienten mit rezidivierenden Thrombosen und/oder Lungenembolien vor dem 45. Lebensjahr, bei positiver Familienanamnese und bei ungewöhnlicher Lokalisation der Thromben beispielsweise in den Mesenterialgefäßen oder in den Venensinus des Kopfes. Die Koinzidenz zwischen einer Verminderung der Blutgerinnungsinhibitoren Antithrombin III, Protein C oder Protein S und einer Thromboseneigung ist durch zahlreiche Untersuchungen belegt. Zu den erworbenen Krankheiten, die mit einer erhöhten Thromboseneigung einhergehen, gehören vor allem Malignome und septische Krankheitsprozesse. Eine praktische Konsequenz hat die Verminderung einzelner Blutgerinnungsinhibitoren auch bei der hormonellen Antikonzeption und in der Schwangerschaft.
Diagnostische Maßnahmen
Als Kardinalsymptome der Phlebothrombose am ambulanten Patienten gelten der Schmerz, das Ödem und die leicht zyanotische Hautverfärbung. Die sogenannten klassischen Thrombosezeichen beruhen darauf, daß durch einen übertragenen Druck oder Zug an den thrombosierten Venen ein Schmerz ausgelöst wird. Am bekanntesten sind der Lowenberg-Test, das Homans- und das Payr-Zeichen, die heute aber wegen der hohen Quote von falschnegativen und falsch-positiven Aussagen nur historische Bedeutung haben.
Die klinische Diagnose einer Phlebothrombose ist mitunter recht schwierig. In der Regel führt der typische Berstungsschmerz in der Wade beim Gehen und Stehen zur ärztlichen Konsultation. Die Schmerzlokalisation ist vom Ort der Thrombose weitgehend unabhängig. Die häufigste Verwechslung erfolgt mit dem Muskelriß, der durch eine ruckartige Reflexbewegung oder durch einen Unfall entsteht; aber auch die Thrombose macht sich zuweilen plötzlich während des Tennisspiels oder beim Aussteigen aus dem Auto bemerkbar. Eine andere Fehlerquelle ist der posttraumatische Schmerz im Gipsverband, der die ersten Symptome der Phlebothrombose überdeckt. Die Beteiligung der Beckenvenen und der V. cava inferior kann starke Rücken- und Lendenschmerzen verursachen.
Das Ödem ist das wichtigste Zeichen der Phlebothrombose. Es tritt aber nur in der Orthostase auf, und zwar in stärkerem Maße bei der popliteofemoralen und der kruralen Thrombose, weniger bei der isolierten Lokalisation im Beckenbereich. Auch die begrenzte Muskelvenenthrombose verursacht eine Verspannung der Wade infolge der Ausbildung des intrafaszialen Ödems. Der Befund ist am besten palpatorisch zu erfassen. Jedes Ödem fällt zuerst in der Bisgaard-Kulisse zu beiden Seiten der Achillessehne bei der Betrachtung im Stehen auf. Die Objektivierung muß durch die Umfangsmessungen der Beine erfolgen.
Das Symptom der lividen Verfärbung läßt sich am entspannt herabhängenden Bein beobachten. Die Sensitivität liegt nach unseren Untersuchungen bei 80%, die Spezifität bei 93%. Auch nicht-obturierende Thrombosen verursachen gelegentlich ein bläuliches Kolorit durch die reaktive Weitstellung der Hautplexus. Hinzu kommt eine auffällige Zeichnung der oberflächlichen Venen (Pratt-Warnvenen).
Beim immobilisierten Patienten sind die Symptome nur diskret ausgebildet oder sie fehlen. Manchmal weist ein dumpfer Druck in der Lendenregion auf die Beckenvenenthrombose hin. Pathognomonisch sind auch unklare fieberhafte Temperaturen (Mahler-Zeichen). Beachtenswert erscheint die Dominanz von Schmerzsyndromen der Grundkrankheit. Die "Embolie aus heiterem Himmel" hat deshalb bis heute ihre Schrecken nicht verloren. Es ist wichtig, bei den Risikosituationen der Virchow Trias an die Möglichkeit der Thrombose zu denken und die Indikation zur Sonographie großzügig auszulegen.
Als besonderes Krankheitsbild ist die Phlegmasia coerulea dolens herauszustellen. Wenn der thrombotische Verschluß bis in die kleinsten Gefäße hineinreicht, droht die venöse Gangrän. Die Diagnose muß durch den klinischen Eindruck und durch nicht-invasive Verfahren gestellt werden, die Phlebographie erscheint kontraindiziert. In allen unseren Fällen lag eine systemische Tumorkrankheit mit dem Zusammenbruch des Hämostasesystems zugrunde, die bald zum Tode führte.
Apparative Diagnostik
Der Stellenwert und die Stufensequenz der apparativen Untersuchungsmethoden haben sich bei der Beinvenenthrombose in den letzten Jahren grundlegend geändert. Die bildgebende Sonographie gilt heute als die Methode der ersten Wahl; im Vergleich zur Phlebographie erreichen die Sensibilität und die Spezifität nahezu 100% (Tabelle 4).
| Tabelle 4. Eignung verschiedener Untersuchungsmethoden zur Thrombosediagnostik in der kruralen, popliteofemoralen und iliokavalen Region |
| Untersuchungsmethode | Diagnostische Verwertbarkeit Gefäßregion krual | Diagnostische Verwertbarkeit Gefäßregion popliteofemoral | Diagnostische Verwertbarkeit Gefäßregion iliakokaval |
| Klinische Untersuchung | |||
| Ambulanter Patient | + | + | (+) |
| Immobilisierter Patient | 0 | 0 | (+) |
| Bildgebende Verfahren | |||
| Real-Time-Sonographie | + + + | + + + | + |
| Farbkodierte Duplexsonographie | + + + | + + + | + + |
| Phlebographie | + + + | + + + | + + + |
| Isotopenphlebographie | (+) | (+) | (+) |
| Physikalische Methoden | |||
| Ultraschall-Doppler | 0 | (+) | + |
| Venenverschlußplethysmographie | 0 | + + | + + |
| Thermographie | + | + | 0 |
| Nuklearmedizinische Tests | + + | (+) | 0 |
Das wichtigste Ultraschallsymptom der Thrombose ist die fehlende Komprimierbarkeit der Vene. Weitere diagnostische Zeichen sind die erhöhte Echogenität des Thrombus, die Verdickung der Venenwand und die Erweiterung des Gefäßlumens im Vergleich zur gesunden Gegenseite. Durch die Einbeziehung der farbkodierten Duplextechnik lassen sich die diagnostischen Aussagen verfeinern (Abbildung 7).
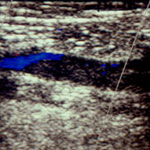 Thrombusschwanz in der V. femoralis communis. Erhöhte Echogenität des Thrombus, fehlende Komprimierbarkeit der Vene mit vergrößertem Lumen, echoreiche Verdickung der Venenwand. Blaue Kodierung des durchströmten proximalen Gefäßabschnitts. Darstellung durch farbkodierte Duplexsonographie.
Thrombusschwanz in der V. femoralis communis. Erhöhte Echogenität des Thrombus, fehlende Komprimierbarkeit der Vene mit vergrößertem Lumen, echoreiche Verdickung der Venenwand. Blaue Kodierung des durchströmten proximalen Gefäßabschnitts. Darstellung durch farbkodierte Duplexsonographie.
Im Bereich des Unterschenkels reicht der Nachweis von echoarmen Zonen in der Muskulatur oder neben den pulsierenden Arterien für die Diagnose aus. Bestimmte Gefäßregionen, wie der Adduktorenkanal und die Beckengegend, sind mitunter schwierig zu beurteilen. Trotzdem erlaubt das Verfahren heute die Beantwortung der Frage "Thrombose ja oder nein?". Die bildgebende Sonographie hat aber auch artspezifische Nachteile. So läßt sich naturgemäß das ganze Ausmaß der Erkrankung in manchen Fällen weder anhand des Videofilms noch der Videoprints vermitteln. Die Kollateralisation des Gefäßverschlusses ist überhaupt nicht zu beurteilen.
In der differenzierten Diagnostik einer Thrombose bietet die aszendierende Phlebographie gegenüber der Duplexsonographie eindeutige Vorteile. Mit der Röntgenuntersuchung sind in der Routine auch kleinste Gerinnsel in den Klappentaschen nachzuweisen, wie sie beispielsweise für die polytope Thrombose des paraneoplastischen Syndroms typisch sind. Die Darstellung der Wadenmuskelvenen gelingt routinemäßig durch den Überlaufeffekt.
Die Nachteile der Phlebographie gegenüber der Sonographie bestehen zum einen in der Invasivität des Verfahrens, was heute in Anbetracht der nebenwirkungsarmen Kontrastmittel jedoch zu vernachlässigen ist, und dann in der fehlenden Beurteilbarkeit der perivaskulären Strukturen. Bezüglich der Altersbestimmung von Thromben bieten Sonographie und Phlebographie ähnliche Unsicherheiten. Die gemeinsame Anwendung der beiden Verfahren gewährleistet aber eine bildliche Dokumentation der Thrombose, die allen Ansprüchen genügt.
Nach der klinischen Untersuchung des Patienten und der bildgebenden Sonographie müßte die Diagnose der Phlebothrombose also gesichert sein, und der Therapeut wird seine Entscheidungen treffen. Vor Einleitung der Thrombolyse und vor einem operativen Eingriff empfehlen wir in jedem Fall die umfassende Dokumentation durch die Phlebographie. Alle anderen apparativen Verfahren vermitteln zusätzliche Informationen. So gibt die Venenverschlußplethysmographie eine Aussage über die Kapazität und die Drainagefunktion des Venensystems der Extremität; bei der nunmehr ja bekannten akuten Thrombose wird sich hierauf aber aus verschiedenen Gründen auch verzichten lassen.
Therapeutische Aspekte
Sobald die Diagnose einer Phlebothrombose gestellt ist, muß die Therapie zur Verhütung einer Progredienz und einer Lungenembolie unmittelbar einsetzen. Der Patient erhält 5000 E unfraktioniertes Heparin iv. und einen Kompressionsverband bis zur Leiste. Dann wird die Entscheidung gefällt, welche Behandlung in Betracht kommt.
Für die Rekonstruktion der venösen Strombahn stehen die Thrombolyse und die Thrombektomie zur Verfügung. Beide Verfahren bringen aber nur dann optimale Resultate, wenn sie innerhalb der ersten 6 Tage nach dem wahrscheinlichen Beginn der Thrombose zum Einsatz gelangen. Vielerorts wird heute die ultrahohe Lyse an die erste Stelle gesetzt; die lytische Wirkung erstreckt sich auf alle Gefäßregionen, also auch auf die peripheren Leit- und Muskelvenen mit ihrem wichtigen Klappenbesatz. Dadurch läßt sich die Entstehung des postthrombotischen Syndroms verhindern. Die frühe Erkennung der Krankheit ist deshalb von grundlegender Bedeutung.
Im Anschluß an die invasive Therapie oder auch als primäre Behandlungsmaßnahme erfolgt die Antikoagulation.
Von großer Bedeutung ist die Kompressionstherapie mit einem fixierten elastischen Verband aus Kurzzugbinden. Für die Langzeitbehandlung eignen sich dann Kompressionsstrümpfe der Klasse III AG (=bis zur Leiste).
Postthrombotisches Syndrom
Dieser Begriff (1954 von Halse eingeführt) umfaßt eine Reihe von Symptomen, die nach einer Thrombose der tiefen Bein- und Beckenvenen bestehen bleiben oder sich im Laufe von Jahren ausbilden. Das Krankheitsbild ist vielgestaltig und reicht von der diskreten Schwellungsneigung bis zu den manschettenförmigen Ulzerationen des chronischen Faszienkompressionssyndroms. Daraus ergeben sich für den Patienten einschneidende berufliche und soziale Probleme. Es wird geschätzt, daß mehr als 1 Mio. Bürger der Bundesrepublik Deutschland an einer postthrombotischen Krankheit leiden. Die Inzidenz nimmt kontinuierlich zu.
Pathogenese und Einteilung
Schon in den ersten Tagen und Wochen nach Beginn der akuten Thrombose setzen die Vorgänge der Reparation und Kompensation ein. Dem Venensystem stehen hierfür 2 Möglichkeiten zur Verfügung, die Rekanalisation und die Kollateralisation.
Die Rekanalisation beginnt mit der Ausbildung von kleinen Hohlräumen innerhalb des Thrombus durch die spontane Fibrinolyse. Die Rekanalisation dauert bis zu 12 Monaten an (=postthrombotisches Frühsyndrom). In 35,5 % der Fälle kommt es zu einer vollständigen Wiedereröffnung der Lumina. Besonders bei Kindern und Jugendlichen wird dieser Verlauf beobachtet, der wahrscheinlich auf einer hohen fibrinolytischen Aktivität der Venenwand beruht. In 53,4% der Fälle bleibt die Rekanalisation unvollständig und in 11,1 % bleibt sie völlig aus.
In entsprechender Weise bewirkt die Ausbildung von Kollateralen eine Verbesserung der Abflußbedingungen bei Obliteration der Leitvenen. Durch die Verschlüsse in der proximalen Strombahn steigt der periphere Venendruck an und wirkt als Reiz für die Ausbildung von Umgehungskreisläufen. Rekanalisation und Kollateralisation haben keine synergistische, sondern eine gegensätzliche Effektivität (Abbildung 8).
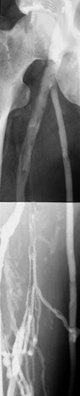 Postthrombotisches Syndrom der Beinvenen rechts. Persistierender Verschluß der V. femoralis superficialis. Kollateralkreislauf über die V. saphena magna. Das Gefäß ist im Sinne der physiologischen Phlebektasie erweitert, die Venenklappen sind aber suffizient geblieben (Gürtelzeichen).
Postthrombotisches Syndrom der Beinvenen rechts. Persistierender Verschluß der V. femoralis superficialis. Kollateralkreislauf über die V. saphena magna. Das Gefäß ist im Sinne der physiologischen Phlebektasie erweitert, die Venenklappen sind aber suffizient geblieben (Gürtelzeichen).Im Laufe der Zeit werden die oberflächlichen Kollateralvenen überlastet und aus der physiologischen Phlebektasie der V. saphena magna entsteht eine sekundäre Slammvarikose. Über insuffiziente Vv. perforantes entstehen Rammeffekte auf das extrafasziale Gewebe. Die Störungen der Mikrozirkulation treten in den Vordergrund. Die Überforderung der Kompensationsmechanismen führt zum postthrombotischen Spätsyndrom.
Diagnostische Maßnahmen
Die eingehende pathomorphologische Beurteilung des postthrombotischen Syndroms ist nur durch die aszendierende Preßphlebographie möglich. Der Röntgenbefund umfaßt eine Beschreibung der Venenklappen, der tiefen Leit- und Muskelvenen sowie der insuffizienten Vv. perforantes; außerdem werden die Kollateralkreisläufe und ihre hämodynamische Funktion betrachtet. Das Phlebogramm ist die Grundlage für die Einschätzung der Krankheit in jeglicher Beziehung.
In der bildgebenden Sonographie ist das Gefäßvolumen mit echoreichen Gefäßstrukturen angefüllt, die eine Charakteristik von Inseln und Septen aufweisen. Nachteile der Methode bestehen u.a. darin, daß die Venenklappen und der Umfang der Kollateralisation nicht zu beurteil
Literaturverzeichnis
Browse NL, Burnand KG (1982) The cause of venous ulceration. Lancet II:243
Coloridge Smith PD, Thomas P, Scurr JH, Dormandy JA (1988) Causes of venous ulceration: a new hypothesis. Brit Med J 296:1726-1727
Hach W (1979) Untersuchungen des extrafaszialen Venensystems unter normalen und pathologischen Bedingungen mit der aszendierenden Preßphlebographie. Demeter, Gräfelfing
Hach W, Hach-Wunderle V (1994) Phlebographie der Bein- und Beckenvenen. Springer, Berlin Heidelberg New York (im Druck)
Hach W, Hach-Wunderle V (1994) Die Rezirkulationskreise der primären Varikose. Springer, Berlin Heidelberg New York
Hach-Wunderle V (1990) Hämostaseologisches Risikoprofil bei venöser Thrombose. Habilitationsschrift, Frankfurt/Main
Halse T (1954) Das postthrombotische Syndrom. Steinkopff, Darmsladt
Langer C, Vorpahl U, Atamar C, Schlick R (1993) Die endoskopische Laser-Fasciotomie. In:
Schulz RM, Bruch HP, Weiß HD. Neue Trends in Diagnostik und Therapie von Venenleiden. Schmidt-Römhild, Lübeck
Netzer C (1968) Die Strömungsverhältnisse beim postthrombotischen Zustandsbild. In: Kappert A, May R (Hrsg) Das postthrombotische Zustandsbild der Extremitäten. Huber, Bern
Pflug JJ (1990) The resting interstitial tissue pressure in primary varicose veins. J VascSurg 11:411-417
zum Anfang
zurück

